临床试验立项工作指引及运行管理流程
发布时间:2022-08-08 09:33
本文来源: 机构办公室 阅读次数:0
分享到:
1.立项前沟通
咨询人可通过电话(0771-3376681)、邮件或到机构办公室进行咨询,咨询时请将试验方案摘要发送到机构办邮箱gxgjzyyygcp[at]163[dot]com,机构办公室将在10个工作日内邮件或电话回复。
2.立项流程
(1)申办方/CRO与机构初步达成合作意向后,应填写《药物临床试验立项申请表》(附件1),并按照《药物临床试验立项申请资料清单》(附件2)准备立项材料,将所有立项材料扫描成电子版以压缩包形式发送到机构办邮箱审查。邮件主题为“药物名称-立项材料”,文件按序号-文件名称-版本号-版本日期”命名。
(2)机构办审查电子版材料认为符合立项要求,申办方/CRO按要求提交纸质版材料。纸质版材料要求:项目全套资料一式2份,使用蓝色2孔文件夹(高度315mm,厚度75mm)分别装订成册;对装订的文件资料要求:封面盖申办方/CRO公司鲜章,若文件有多页,还需加盖申办方/CRO公司骑缝章,不同内容的材料之间有分隔页。
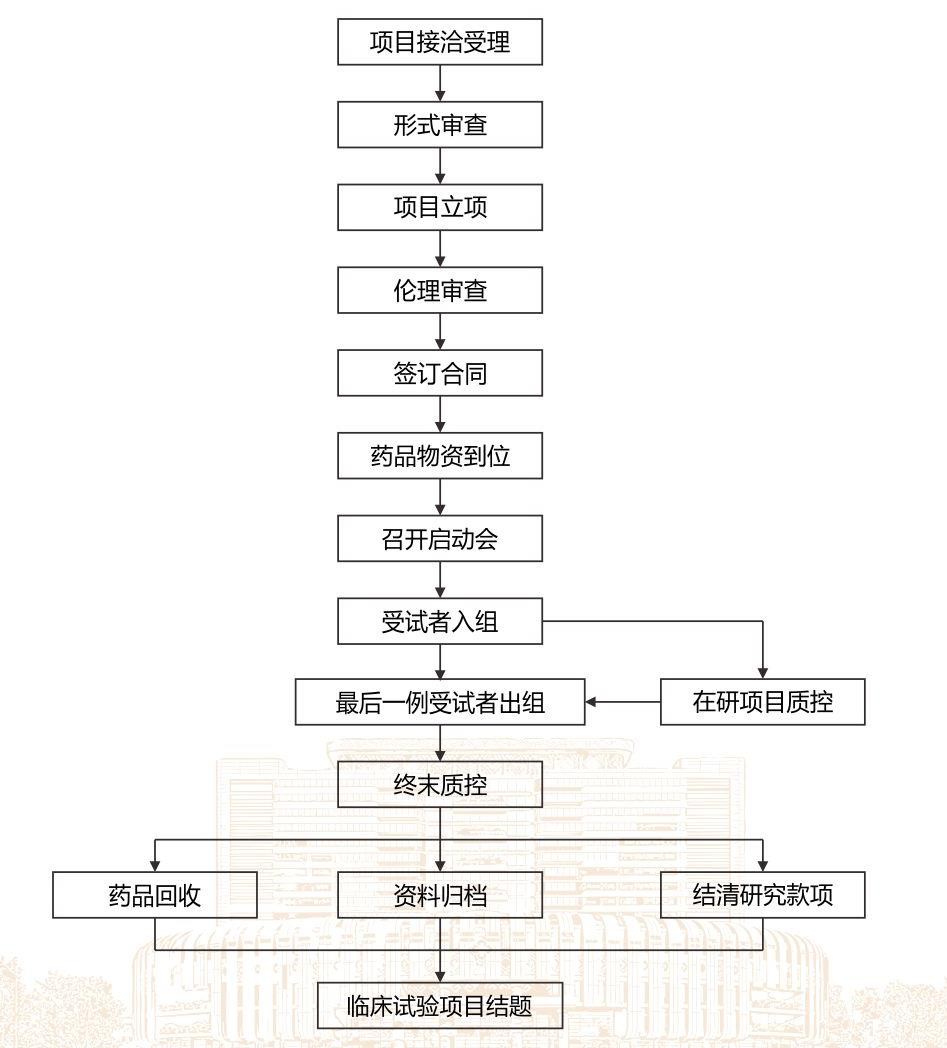
3. 药物临床试验运行管理流程
扫一扫 手机端浏览

